La costante di dissociazione e quella di idratazione
Prima di arrivare al famoso effetto tampone, abbiamo bisogno di introdurre il concetto di costante di dissociazione acida.
Abbiamo detto che gli acidi si dissociano liberando ioni H+.
Questo processo avviene anche in senso inverso: gli ioni si ricompongono formando di nuovo l’acido, e si instaura un equilibrio di dissociazione.
Dato un acido con una formula del tipo HA, questo si dissocia secondo la seguente reazione:
HA ↔ H+ + A–
Lo ione A– viene anche chiamato base coniugata.
Questa reazione è regolata da una costante, detta costante di dissociazione acida (Ka), che è definita come:
![Ka=[H+][A-]/[HA]](https://acquariofilia.org/wp-content/uploads/2017/07/Ka-300x119.jpg)
Ovvero il prodotto delle concentrazioni dei due ioni, diviso la concentrazione dell’acido non dissociato.
Attenzione: quando parliamo di concentrazione di ioni H+ stiamo semplificando. In realtà intendiamo ioni H3O+.
Ka è un numero che dipende principalmente dalla temperatura, ed ha un valore specifico per ogni acido.
La costante di dissociazione ci permette di distinguere acidi forti e acidi deboli:
- i primi, in soluzione, si dissociano quasi totalmente, e la loro costante di dissociazione è un numero molto alto;
- i secondi si dissociano solo parzialmente, e la loro costante di dissociazione è un numero molto piccolo.
Nel caso dell’acido carbonico, che è un acido debole, abbiamo
![Ka=[H+][HCO3-]/[H2CO3]](https://acquariofilia.org/wp-content/uploads/2017/07/Ka_carb-300x97.jpg)
che vale circa 2,5×10-4 a temperatura ambiente.
Usando questa formula possiamo fare qualche calcolo interessante, ad esempio:
quante molecole di acido carbonico abbiamo per ogni ione HCO3–, ad un dato pH?
È sufficiente invertire, e otterremo:
![[H2CO3]/[HCO3-] = 10^-pH/2,5×10^-4](https://acquariofilia.org/wp-content/uploads/2017/07/h2co3hco3-300x90.jpg)
Quindi, a pH neutro, avremo una molecola di acido carbonico ogni 2500 di HCO3–.
Abbiamo visto che anche lo ione bicarbonato può dissociarsi:
HCO3– ↔ H+ + CO32–
E anche in questo caso abbiamo una costante di dissociazione:
![Ka1=[H+][CO32-]/[HCO3-]](https://acquariofilia.org/wp-content/uploads/2017/07/Ka1-300x96.jpg)
che vale circa 4,69×10−11.
Con qualche passaggio matematico, possiamo calcolare la concentrazione relativa fra acido carbonico, ione bicarbonato e ione carbonato in funzione del pH:
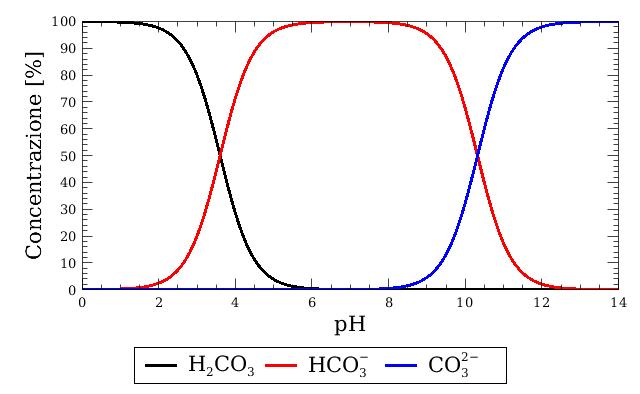
Un’altra formuletta che ci interessa è quella che regola l’equilibrio tra CO2 disciolta e acido carbonico.
Anche qui abbiamo una costante di equilibrio tra le due specie ma, in questo caso, si chiama costante d’idratazione, che è definita come:
![Kh=[H2CO3]/[CO2]](https://acquariofilia.org/wp-content/uploads/2017/07/Kh_copia-300x126.jpg)
e che vale circa 1.7×10−3.
Il che significa che avremo 17 molecole di acido carbonico ogni 10000 molecole di CO2 disciolte.
Notate che, nonostante l’acido carbonico sia una piccolissima parte della CO2 disciolta, è proprio questa piccola parte che, da sola, provoca l’acidificazione dell’acqua.





















