L’effetto tampone… colpisce ancora!
Ora che abbiamo visto cosa succede quando aggiungiamo un acido in acqua, in presenza di bicarbonati, torniamo a parlare dell’effetto tampone.
Abbiamo visto che noi acquariofili associamo l’effetto tampone alla relazione tra CO2 e KH.
In realtà in chimica, con effetto tampone, si intende qualcosa di diverso.
In chimica, si chiama soluzione tampone una soluzione acquosa contenente un acido debole e la sua base coniugata, o una base debole e il suo acido coniugato.
Se la formula dell’acido è HA, la base coniugata non è altro che lo ione A–.
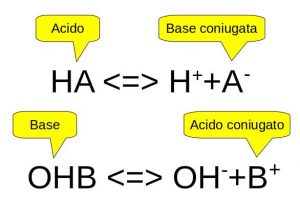
Queste soluzioni hanno la proprietà di opporsi alle variazioni di pH, in caso di aggiunte di piccole dosi di acidi o basi forti.
Il potere tamponante di una tale soluzione è la misura della sua capacità di opporsi alla variazione del pH, a seguito dell’aggiunta di una certa quantità di acido forte o base forte.
Che significa? Significa che, se aggiungiamo un po’ di acido forte in una soluzione tampone, la variazione di pH sarà più piccola di quella che avremmo in acqua distillata.
In una soluzione tampone, infatti, la base coniugata cercherà di ricombinarsi con gli ioni H+ rilasciati dall’acido forte, in modo da ristabilire l’equilibrio dettato dalla costante di dissociazione.
La soluzione tampone che ci interessa è quella composta dall’acido carbonico (che è un acido debole) e dallo ione bicarbonato (che sarebbe la sua base coniugata).
A sua volta, però, lo ione bicarbonato si comporta come un acido debole, la cui base coniugata è lo ione carbonato.
Esistono altri acidi deboli che si possono trovare in acquario, come ad esempio tutti gli acidi umici, e anche qualche base debole, come l’ammoniaca.
Come vedete, il concetto di soluzione tampone e potere tamponante è diverso da quello di effetto tampone che usiamo in acquariofilia.
Entrambi sono legati alla costante di dissociazione dell’acido carbonico. Ma, mentre nel «tampone acquariofilo» aggiungiamo anidride carbonica/acido carbonico (quindi uno degli ingredienti della soluzione tampone), nel «tampone chimico» aggiungiamo un acido esterno.
Vuol dire che fino ad adesso gli acquariofili non hanno capito niente?
No; il fatto è che a noi acquariofili interessa principalmente la CO2 e il suo effetto sul pH.
È però importante non confondere questi due concetti quando si discute con un chimico…
In realtà, anche noi acquariofili usiamo, talvolta, il concetto di effetto tampone come lo intendono i chimici.
Troviamo spesso dire che a KH basso, il pH è poco stabile. Ma pH stabile rispetto a cosa? Innanzi tutto stabile rispetto alla aggiunta di acidi!
Acidi che possiamo introdurre noi volontariamente (immettendo ad esempio dell’estratto di quercia) o dovuti ad altri processi dell’acquario (come gli acidi umici prodotti dalla decomposizione del materiale organico).
Abbiamo già visto, nel capitolo precedente, cosa succede quando aggiungiamo dell’acido in acqua.
Se prendiamo il caso di una concentrazione di CO2 pari a 30 mg/L, otteniamo questo grafico:
Possiamo facilmente vedere che la variazione di pH per l’aggiunta di una piccola quantità di acido diminuisce all’aumentare del KH.
Ad esempio, se aggiungiamo 0,1 mmol/L di acido, per KH=8 la variazione di pH è minuscola, mentre per KH=0,5 il pH passa da 5,8 a 5,4.
Questo è esattamente l’effetto tampone di cui parlano i chimici! E possiamo quindi affermare che il potere tamponante aumenta all’aumentare della durezza carbonatica KH dell’acqua.